はじめに
デザイナーベイビーというキーワードが気になり、遺伝子治療やゲノム編集の技術的な動向や課題を調べてみたいと思った。難解な用語も多いが、遺伝子工学が飛躍的に発展していることは理解できた。また、年率74%の増という急成長する市場ができつつある。新型コロナへの対応という追い風を受けて、この予想を超えるペースで増加するだろう。そして、このDNA編集の技術は世論を巻き込みながら様々な生物への適用がチャレンジされるのだろう。倫理的な問題が大きいが、これもマスメディアがどのように報道するかで大きく世論は変わるだろう。
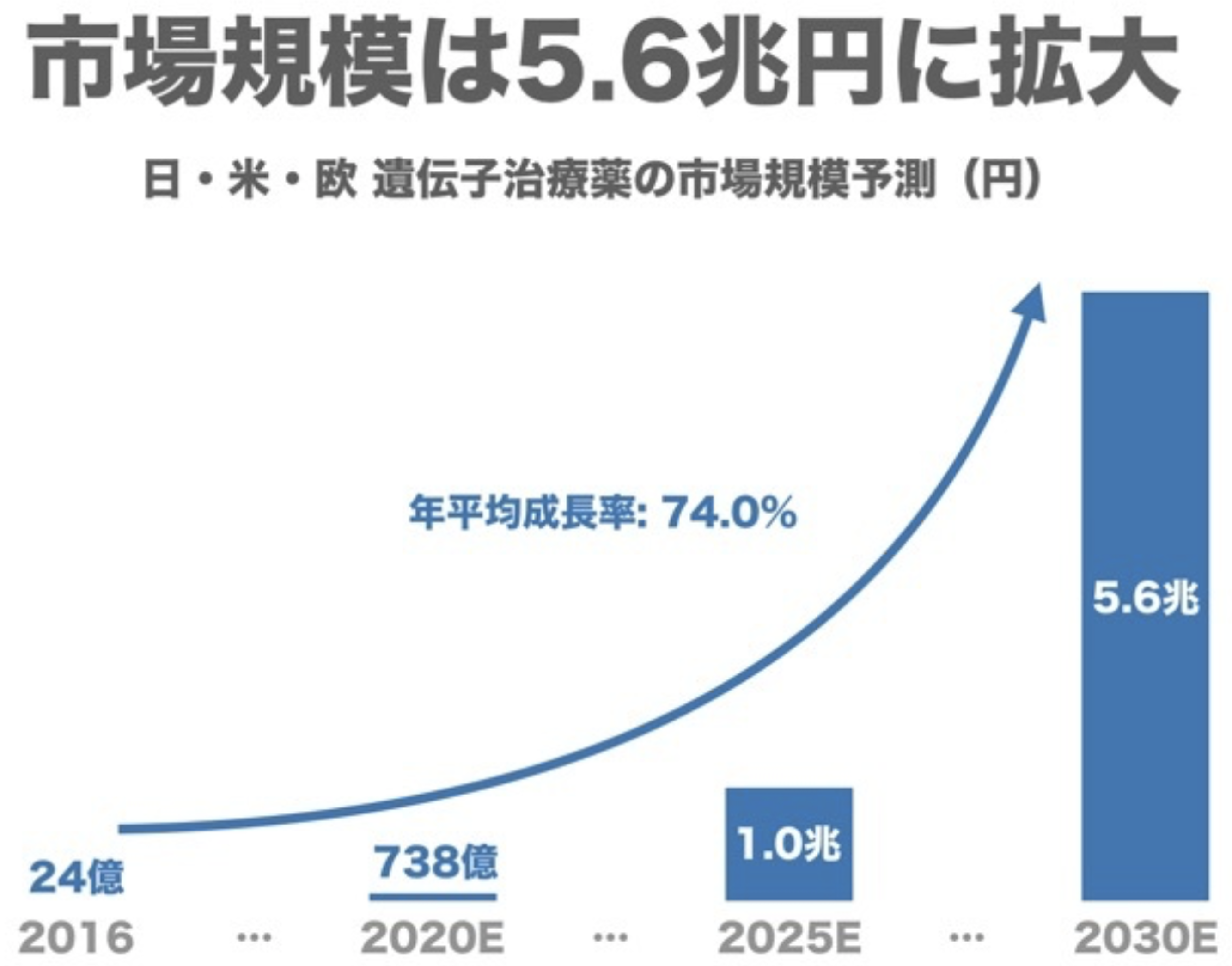
遺伝子治療薬の市場規模(年平均74%増)
市場調査会社のシード・プランニングは、日米欧の3地域における遺伝子治療薬(ゲノム編集を含む)は、2016年の24億円から2030年には5.6兆円まで増大すると予測する。年平均成長率はなんと74%だ。2019年末から始まった新型コロナ(COVID-19)に対するmRNAタイプのワクチンは2021年で8兆円規模と予想されており、この予測をはるかに上回るペースで増大している。
(出典:Strainer)
蛍光色で光る鑑賞フィッシュ(GloFish)
昨日は、金魚の「金魚で遡る日本人の起源」について投稿したが、米国では一部の地域(CA州)を除き、遺伝子操作で蛍光色に光鑑賞フィッシュ(GloFish)を1匹5ドルで購入できる。金魚(GoldFish)から光る魚(GloFish)に進化している。GloFishを販売している会社はさらに水質汚染対策への活用を検討している。つまり、環境に有害な物質があれば発色する魚だ。2009年には、遺伝子を組み込んで赤色になる珊瑚礁レッドゼブラダニオ)が未承認で日本に輸入され、カタルヘナ法違反として指導を受けている。カタヘルナ法とは、正式には、「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」と言い、遺伝子組換えなどのバイオテクノロジーを活用して作製された生き物の使用を規制する法律である。カタヘルナ議定書に基づいて、2004年2月19日に施行された。

(出典:朝日新聞)
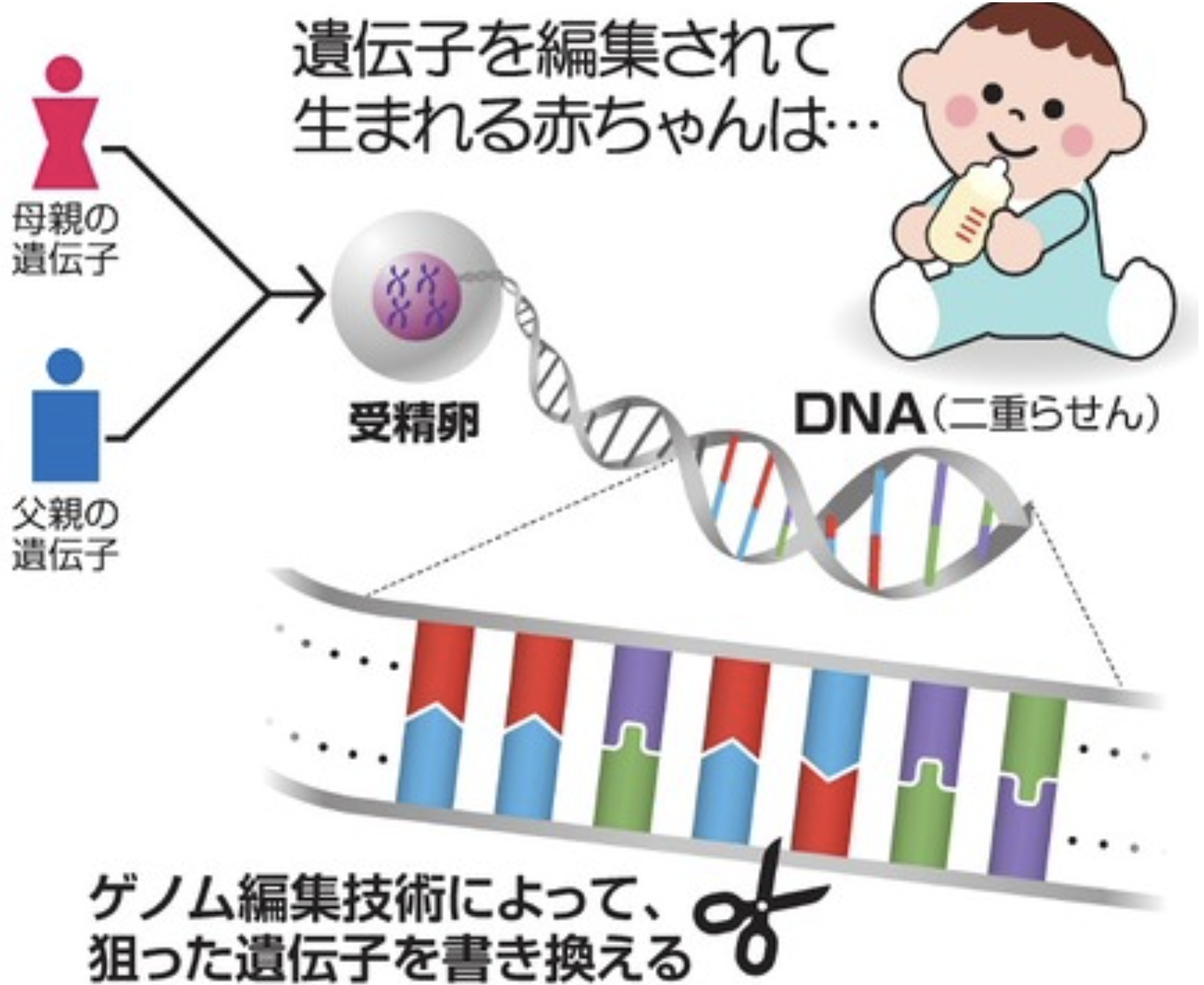
デザイナーベイビーの可能性
デザイナーベイビーという言葉を聞いたことがありますか?赤ちゃんが生まれる時には、もう5体満足であればそれだけで十分と願う癖に、大きくなったら色々と期待も膨らんでしまう。中国の研究者が2018年にゲノム編集した受精卵から双子が生まれたと発表した。今回はエイズウイルスに感染しにくいようにゲノム編集をしたものだったが、世界中で批判や懸念の声が相次いだ。ドイツやフランスは受精卵のゲノム編集を法律で禁じている。米国は連邦政府の資金投入を制限することで研究に歯止めをかける。英国は国の機関が厳しく審査し、中国は指針で認めていない。日本では、研究の範囲で子どもの誕生を禁じているが、医療行為では止められない懸念があった。2001年に施行された「ヒトクローン技術規制法」では、クローン人間の誕生を禁じている。親が望む容姿や能力を有するデザイナーベイビーの誕生を倫理面、法律面でどのように整理するのかは問題だ。
(出典:朝日新聞)
ゲノム編集の3つの方法
ゲノム編集(Genome Editing)とは、生物が持つゲノムの中の特定のDNA配列を編集することだ。ゲノム編集の手法としては、ウイルスベクターによる方法、プラスミドによる方法、コロナワクチンで有名になったメッセンジャーRNA(mRNA)による方法などがある。また、代表的なゲノム編集技術であるZFN、TALEN、CRISPRの3つの方法について簡単に説明する。

(出典:独立行政法人医薬品医療機器総合機構)
ZFN
ZFN(Zinc Finger Nucleases)は、ジンクフィンガーDNA結合ドメインとDNA切断ドメインを融合させて作る人工制限酵素だ。ジンクフィンガーとは、タンパク質ドメインの大きなスーパーファミリーの1つであり、DNAに結合する性質を持つ。1996年に発表された方法であり、トウモロコシ遺伝子導入細胞における標的遺伝子座に適用されている。
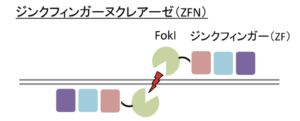
(出典:ゲノム編集の歴史と基礎)
TALEN
2010年に発表された手法である。TALEN(Transcription Activator-Like Effector Nuclease)とは、転写活性化因子様エフェクターヌクレアーゼ(TALEN)の33または34アミノ酸の繰り返し配列を特徴とする特異的なDNA結合タンパク質である。TALENは、ヌクレアーゼのDNA切断ドメインとTALEドメインを融合させて設計された人工制限酵素であり、固有のDNA配列を認識するように調整できる。生きている細胞の中で、配列の挿入、削除、修復、置換などの目標とするゲノムの変更を行うことができる遺伝子編集アプリケーションにおいて、標的となりやすい「DNAはさみ」として機能する。TALENは全ゲノム中の任意の1つのヌクレオチドから6塩基対の範囲内で実行できる。DNA結合特異性が高い、オフターゲット効果が低い、DNA結合ドメインの構築が容易といったメリットがある。
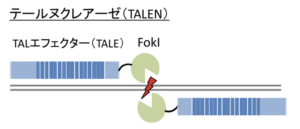
(出典:ゲノム編集の歴史と基礎)
CRISPR
2012年に発表された手法である。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)は細菌がウイルスから身を守るために一種の獲得免疫として使用する遺伝子要素である。ウイルスのゲノムに由来する短い配列が細菌のゲノムに組み込まれたものである。CRISPR関連タンパク質は、その配列を処理し、ウイルスのDNA配列と一致するものを切断する。この方法はゲノムDNAの鎖を切断する必要がないため、DNA鎖の切断に伴うランダムな挿入や欠失を避けることができる。1塩基の変更を必要とする精密な編集にのみ適しており,この種の編集では非常に効率的だ。なお、このCRISPRで2020年のノーベル化学賞を受賞したのはフランスのエマニュエル・シャルパンティエと、米国のジェニファー・ダウドナ氏だ。しかし、このCRISPRの奇妙なDNA配列を見つけて1987年に論文として発表したのは九州大学の石野良純教授だった。それはDNA配列の中で奇妙に繰り返されていたCGGTTTだった。惜しい。

(出典:ゲノム編集の歴史と基礎)
遺伝子工学の変遷
DNAの発見
遺伝子の構造が二重らせんモデルであることは、WatsonとCrickにより1953年の発表で明らかになった。遺伝子の化学的本体がDNAであることは1940年代から分かっていたが、二重らせんモデルにより、細胞分裂の際にDNAが元のDNAと全く同じように複製する仕組みや、DNAのもっている遺伝情報がRNAを経てタンパク質に伝えられる仕組みが解明された。
バイオハザードの懸念(1975年)
1970年代になると遺伝子工学の飛躍的な発展による無限の可能性と懸念について注目が集まった。懸念に対しては、倫理面での問題としてのバイオハザードのリスクだ。ポール・バーグによる本格的な遺伝子組換え実験を契機として、1975年のアシロマ会議で遺伝子組換え実験の規制に関して議論された。
カルタヘナ議定書(2003年)
2000年1月29日にモントリオールで署名され、2003年9月11日に発効した。日本では2004年2月19日に発効している。遺伝子組換え生物が国境を越える移送、取扱、利用の手続きを規定している。遺伝子組み換え作物などの輸出入時に輸出国側が輸出先の国に情報を提供、事前同意を得ることなどを義務づけている。カルタヘナとは、この条約に関する最初の会合が開催されたコロンビアの地名(カルタヘナ)が由来だ。日本では従来の組換えDNA実験指針に代わり、この「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律(カルタヘナ法)」が制定された。

(出典:地球の歩き方)
遺伝子ノックアウトと遺伝子ノックイン
遺伝子の特定のDNA配列を削除することを遺伝子ノックアウトと呼ぶ。逆に、特定の遺伝子座に特定のDNA配列を挿入することを遺伝子ノックインという。
条件付きノックアウトマウスの作製
特定の条件で遺伝子をノックアウトする技術も革新している。従来の方法だと、数年かかったものが、最新の方法だと最短1ヶ月で実施できる。ゲノム編集ではどうしても2ステップが必要で、従来の方法では、後輩を繰り返しながら実施したが、最新の方法では受精卵に左のIoxを挿入し、次に右のIoxを挿入し、胚移植することで実現している。
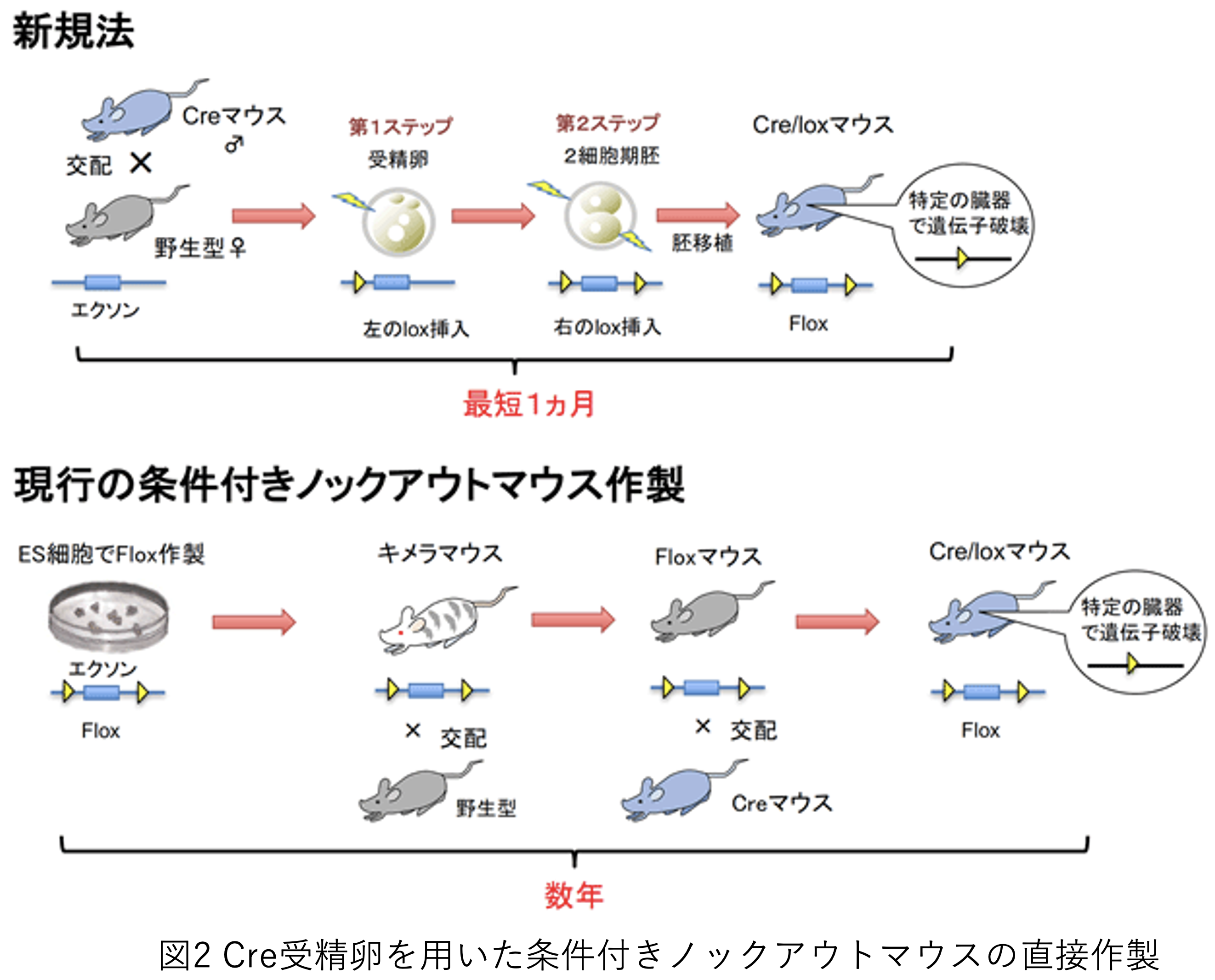
(出典:日本医療研究開発機構)
遺伝子ノックイン
遺伝子ノックイン(KI)は、遺伝子座のDNA配列情報を1対1で置換したり、遺伝子座内に存在しない配列情報を挿入する手法だ。ノックイン技術は、対象遺伝子やほかの遺伝要素を染色体上の特定部位に挿入することができる。遺伝的に修正された細胞は系譜追跡や分析と同様に有効だ。近年開発されたアプローチは、予め決定しているゲノム内の安全な部位に導入遺伝子を送達する手法だ。
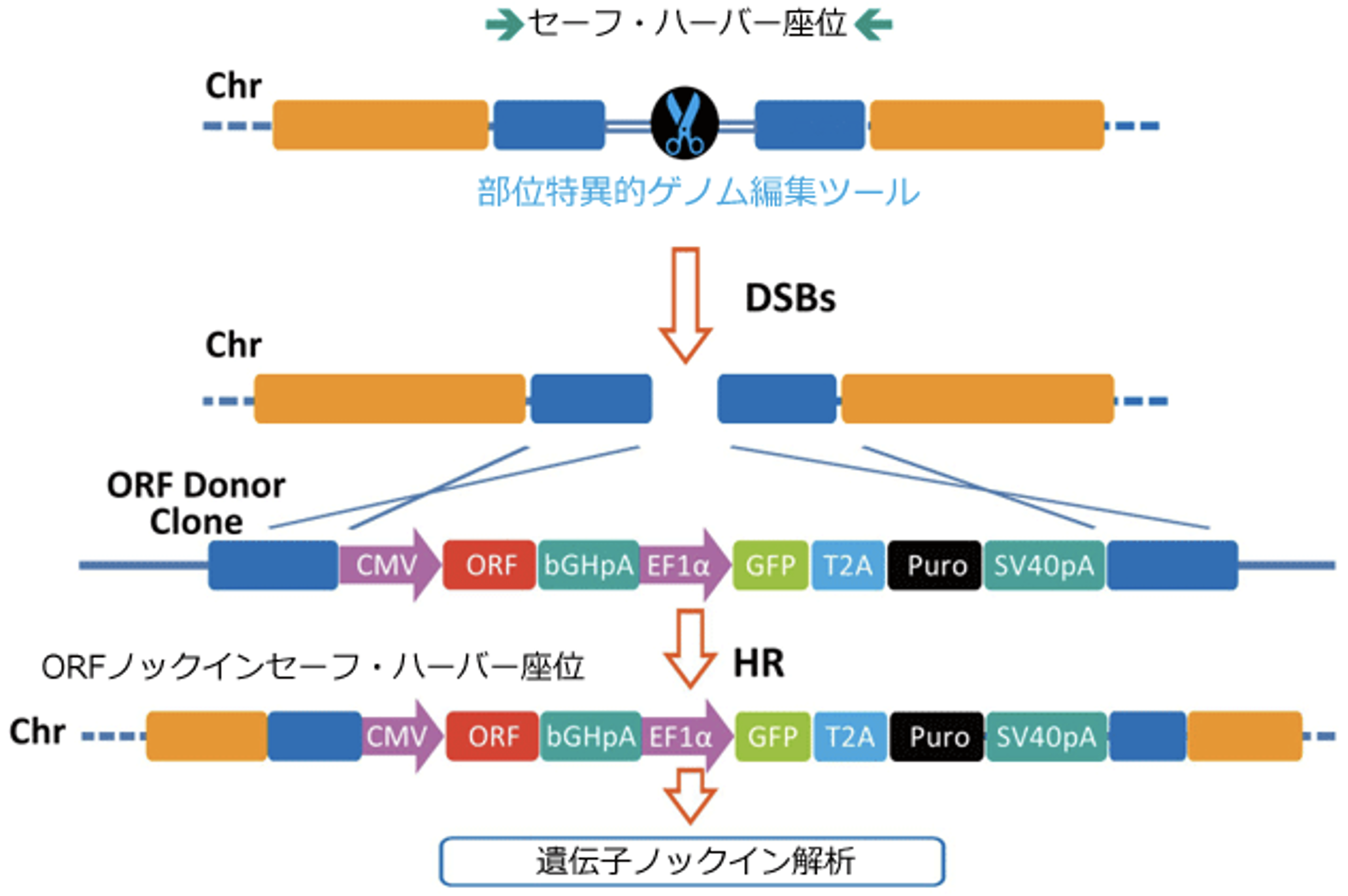
(出典:コスモ・バイオ株式会社)
デザイナーベイビーの可能性と課題
倫理面の問題
人間が生物の遺伝子を操作することの是非論だ。DNA上の重要な欠陥を解決する治療的な問題なのか、親が求める容姿や能力を具備するための措置なのか。前者に対しては、優生学の問題とも関係する。また、後者に対しては、子供は親の所有物ではない。親が希望する通りのDNAを実現したとしても、子供には子供の人格がある。親のエゴなのか、親の愛情なのか、社会が許容するのか、非常に長い時間をかけて解決すべき問題だ。軽々に判断すべきではない。
非可塑性の問題
DNAは生物の設計図とも言われる。その設計図を改変した場合に、それは対象者だけの問題ではなく、その子孫に対しても影響を与える。また、一度実施したDNAの削除や追加、変更を元に戻すことはできないと考えるべきだろう。エピジェネティクスとは、DNAの配列変化によらない遺伝子発現を制御・伝達するシステムおよびその学術分野のことである。遺伝子の発現は、DNAのサイレンサー領域に結合するリプレッサータンパク質の働きによって制御することができる。このようなエピジェネティックな変化は,生物の根本的なDNA配列の変化を伴わないにもかかわらず,細胞分裂を経て一生続く場合もあれば,何世代にもわたって続く場合もある。真核生物におけるエピジェネティックな変化の一例として,細胞分化のプロセスが挙げられる。
エスカレーションの問題
欲望とは限りないものだ。初期の段階では、重篤な障害を取り除くためのDNA編集に限定されていても、経験を重ねると望ましい容姿や能力の獲得のためのDNA編集を実施してほしいという要望や実施したいという要望を抑えきれなくなるのではないだろうか。DNAは生物の設計図であっても、生物はDNAのみで成り立っているものではない。DNAの編集だけでは期待する効果を得られない時には更なる探究を続けるのではないだろうか。まさに、神の領域に一歩足を踏み込むとそこから抜け出せないだけではなく、競争原理も働くとどんどんとニーズとウオンツがエスカレーションすることを懸念する。
まとめ
遺伝子操作については、慎重な対応が求められていたはずだけど、新型コロナの感染爆発とそれに対する危機意識を煽るような報道の後に唯一の解決策としてのワクチンが登場し、各国が競って確保に走っている。マスコミも政府の無作為を非難する論調でワクチンの接種を奨励する報道が続いている。しかし、今回のワクチンはメッセンジャーRNA方式だ。これまでのインフルエンザのワクチンとは全く原理が異なっている。しかし、すでに国内でもワクチン接種率は6,300万人以上の人は1回以上摂取している。自分もすでに1回は摂取した。2回目は来週だ。mRNAについては、効果も大きいが、副反応の解明や対策もこれからだ。最初に記載したように日米欧の遺伝子治療薬の市場は倍倍ゲームで増大中だ。コロナのmRNAワクチンを含めるとこれは本当に巨大な市場となる。そして、デザインベイビーへは倫理面の課題を含めて懸念意見も多いだろう。まずは、ペット市場に対して、デザインペットなどが登場するのではないだろうか。すでに筋肉の発達を抑制するミオスタチン遺伝子を胚の段階で取り除き、筋肉量を増やした犬なども発表されている。より早く走れる競馬の馬をDNA操作で生み出すことは倫理的に許されるのだろうか。サラブレッドのゲノムを解析などの研究は進んでいる。8月24日から東京パラリンピックが開催されている。将来は、遺伝子を操作した人々が競いあるジェネリンピックでも開催されることになるのだろうか。
以上
最後まで読んで頂きありがとうございます。
拝
参考)世界のワクチン接種比率
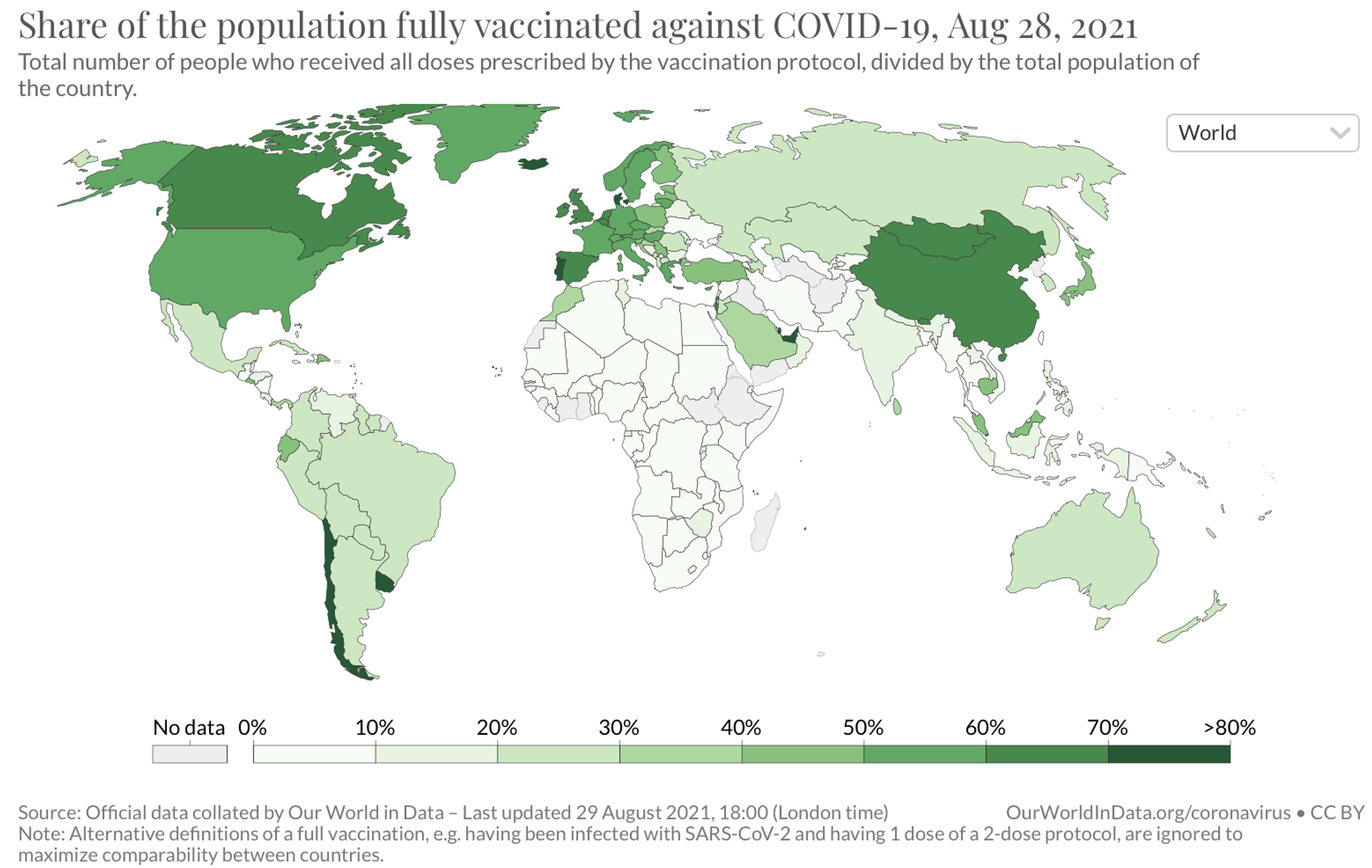
(出典:Our World in Data)